Mammacarcinoom
Mammacarcinoom
Auteur: C.G. Vos, MD PhD - chirurgisch.nl - Laatste update: 27-05-2016
Mammacarcinoom
Algemeen
- Definties:
- Ductaal carcinoom: carcinoom uitgaand van de melkgang
- Lobulair carcinoom: carcinoom uitgaand van de melkklier
- Carcinoma in situ: carcinoom beperkt tot klierstructuren zonder invasie van omliggende steunweefsels
| Cijfers | |
|---|---|
| Incidentie | 14.000 p/j |
| Prevalentie (lifetime) | 12-13% |
| Man:Vrouw | 1:140 |
| Prevalentie |
<40 jaar: 1% <55 jaar: 9% >55 jaar: 37% |
- Risicofactoren:
- - Hogere leeftijd
- - Oestrogeenblootstelling
- - Eerder mammacarcinoom
- - Eerder ovariumcarcinoom
- - Familiare belasting
- - Genmutaties (BRCA-1 & 2)
- - Radiotherapie thorax
Klinische presentatie
ANAMNESE:
- Klachten:
- - Zwelling
- - Beloop in relatie tot cyclus
- - Pijn
- - Tepeluitvloed (bloederig of niet)
- - Huidveranderingen
- Oestrogeenblootstelling:
- - Zwangerschap
- - Menarche
- - Menopause
- - Orale anticonceptie
- Familieanamnese:
- - Mammacarcinoom (leeftijd)
- - Ovariumcarcinoom (leeftijd)
- - Genmutaties (BRCA 1 & 2)
- Voorgeschiedenis:
- - Mammacarcinoom
- - Ovariumcarcinoom
- - Radiotherapie thorax
LICHAMELIJK ONDERZOEK:
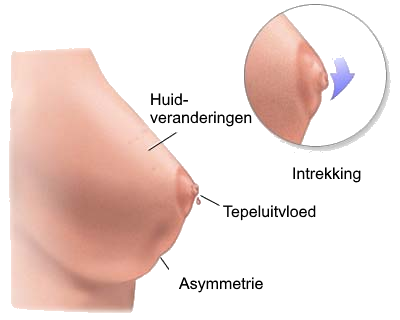
- Inspectie (zittend of staand):
- - Asymmetrie
- - Zichtbare zwelling
- - Huidafwijkingen (kleur, intrekking, ulceratie, oedeem, peau d orange)
- Palpatie (rugligging):
- - Palpabele zwelling
- - Grootte
- - Pijnlijk
- Differentiëren tussen myopectorale pijn (aanhechting m. pectoralis) en
pijn in de mamma - - Consistentie
- - Afgrensbaarheid
- - Tepeluitvloed
- - Palbabele lymfeklieren axilair of supra- & infraclaviculair

Differentiaal diagnose
| Differentiaal diagnose | |
|---|---|
| Atheroomcyste | Benigne zwelling in de huid, uitgaande van de haarfollikel |
| Lipoom | Benigne subcutane zwelling bestaande uit vetweefsel. |
| Mastopathie | Verzamelnaam voor benigne cyclusgebonden borstklachten |
| Cysten | Benigne gladde zwelling met epitheelwand gevuld met vocht, zelden na menopauze. |
| Fibroadenoom | Benigne, mobiele, scherpafgrensbare tumor, zelden na menopauze. |
| Mastitis | Benigne ontsteking van de borst, bij uitblijven van vlotte genezing is aanvullende diagnostiek aangewezen. |
| Intraductaal papilloom | Benigne zwelling van de melkgang, kan leiden tot verstopping van de melkgang en zwelling. |
| Phyllodes tumor | Zeldzame tumor, uitgaande van het periductale bindweefsel. Ongeveer een derde is maligne. |
Diagnostiek
- Mammografie CranioCaudaal (CC) & Medio-Lateraal Oblique (MLO):
|
|
- Echo mamma:
- Indicatie:
- - Jonge (<30 jaar) symptomatische vrouwen
- - Zwangere vrouwen of vrouwen die borstvoeding geven
- - Nadere karakterisering van gevonden massa s
- - Ten behoeve van echogeleide punctie of biopsie
|
|
- MRI mamma:
- - Standaard pre-operatieve MRI wordt niet geadviseerd
- - Wens tot mammasparende therapie (MST) en discrepantie in omvang bij klinisch, mammografisch, en echografisch onderzoek
- - Wens tot MST bij invasief lobulair carcinoom, tenzij er een unifocale massa is op een goed beoordeelbaar mammogram
- - DCIS bij de wens voor MST en een hooggradig DCIS met onduidelijkheid over de tumorgrootte of wanneer er sprake is van DCIS met verdenking op (micro)invasie
- Pre-operatieve cytologie:
- - Doel: Ter bevestiging maligniteit
- - Bloom Richardson
- - Indicatie: evidente solide laesies (massa’s), ongeacht of deze palpabel of niet-palpabel zijn
- - Uitslag: Goedaardige laesie, niet eenduidig benigne of verdacht voor maligniteit, maligne
- Pre-operatieve histologie:
- - Doel: Tumor typering en vaststellen hormoonstatus
- - Indicatie: Niet conclusief cytologie, slecht afgrensbare solide laesies, architectuurverstoringen, radial scars, microcalcificaties, (ect. status hormoonreceptoren en HER2, gradering)
- - Additioneel voordeel: plaatsen van een marker bij stereotactische biopsie en MRI-geleide biopsie
- Disseminatie onderzoek:
- - Routinematig disseminatieonderzoek wordt niet aanbevolen voor stadium I en II tumoren
- - Geïndiceerd bij stadium III tumoren, overweeg bij stadium II cN1 tumoren
- - FDG-PET kan het conventionele disseminatie onderzoek (skeletscintigrafie, echografie van de lever, X-thorax en CT) vervangen
- - Bij voor metastasen verdachte klachten wordt aanvullend onderzoek naar metastasen verricht
- Nieuwe technieken: Breast Tomosynthesis en Contrast-Enhanced Spectral Mammography (CESM)
BIRADS
BI-RADS (Breast Imaging Reporting and Data System-classification) classificatie wordt gebruikt in radiologische verslaglegging en geeft richting aan het verdere beleid| BI-RADS | Beschrijving | Advies | Kans op maligniteit |
|---|---|---|---|
| 0 | Onvolledig onderzoek | Nieuwe beeldvorming of vergelijking met voorgaand onderzoek noodzakelijk. | |
| 1 | Normaal | Geen afwijkingen aantoonbaar | |
| 2 | Benigne | Er wordt een benigne afwijking gezien, bijvoorbeeld een cyste of lipoom | |
| 3 | Waarschijnlijk benigne | Waarschijnlijk benigne laesie. Aanvullende punctie of een controle na 6 maanden. | <2% |
| 4A | Mild verdacht | Waarschijnlijk maligne laesie. Aanvullende punctie moet verricht worden. | >2% - <10% |
| 4B | Matig verdacht | Waarschijnlijk maligne laesie. Aanvullende punctie moet verricht worden. | >10% - <50% |
| 4C | Ernstig verdacht | Waarschijnlijk maligne laesie. Aanvullende punctie moet verricht worden. | 50% - <95% |
| 5 | Maligne | Zeer verdacht voor maligniteit. Aanvullende punctie moet verricht worden. | >95% |
| 6 | PA-bewezen maligne | Bijv. bij beeldvorming ter beoordeling effect neoadjuvante therapie. | 100% |
TNM-classificatie
TNM-classificatie
| T - Primaire tumor | |
|---|---|
| Tx | Primaire tumor kan niet beoordeeld worden |
| T0 | Geen bewijs voor een primaire tumor |
| Tis | Carcinoma in situ |
| T1 | Tumor kleiner dan 2cm |
| T2 | Tumor groter dan 2cm maar kleiner dan 5 cm |
| T3 | Tumor groter dan 5cm |
| T4 | Tumor met invasie van borstwand of huid |
| N – Regionale lymfeklieren | |
| Nx | Regionale lymfeklieren kunnen niet worden beoordeeld |
| N0 | Geen regionale lymfeklier metastasen |
| N1 | Mobiele ipsilaterale axillaire lymfekliermetastase |
| N1mi | Micrometastase (>0,2 mm of >200 cellen, maar <2,0 mm) in ipsilaterale axillaire lymfeklier |
| N2 | Niet-mobiele ipsilaterale axillaire lymfekliermetastase of retrosternale lymfekliermetastase zonder axillaire metastasen |
| N3 | Ipsilaterale infra- of supraclaviculaire lymfekliermetastase of een retrosternale lymfekliermetastase met een axillaire metastase |
| M – Metastasen | |
| Mx | Metastasen kunnen niet worden beoordeeld |
| M0 | Geen afstandsmetastasen |
| M1 | Afstandsmetastasen |
Stadium
| Stadium | T | N | M |
|---|---|---|---|
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| IIIA | T3a | N0 | M0 |
| IIIB | T3b | N0 | M0 |
| IIIC | T4 | N0 | M0 |
| IVA | Elke T | N1 | M0 |
| IVB | Elke T | Elke N | M1 |
Niet-operatieve behandeling
- Adjuvante systemische therapie:
- - Positieve klieren ≤70 jaar
- - Negatieve klieren maar:
<35 jaar (behalve graad I tumoren <1cm)
≥35 jaar met tumor van 1,1-2 cm (graad II of hoger)
≥35 jaar met tumor >2 cm - - Overweeg chemotherapie bij elke HER2 positieve tumor ≥0,5cm, ongeacht andere kenmerken
- - Overweeg hormonale therapie bij postmenopauzale vrouwen met een tumor van 1,1-2 cm, graad II, HER2 negatief maar ER en PgR > 50%
- Chemotherapie:
- - Tot 70 jaar of bij fitte 70+ patiënten met hormoonreceptor negatieve tumor.
- Hormoontherapie:
- - Bij hormoonreceptor positieve tumor (geen leeftijdsgrens).
- Trastuzumab:
- - Bij HER2 overexpressie en een ejectie fractie ≥50%.
- Radiotherapie (RT):
- - Na MST
- - Na ablatio bij: irradicaliteit, T4 tumoren, T3 met angio-invasieve groei, graad III, of ≤40 jaar
- - Overwegen na ablatio en pN1-3 met een van de volgende kenmerken:
angio-invasieve groei
graad III
leeftijd ≤40 jaar
grootte van de tumor ≥3 cm - - Overwegen na ablatio en pN0 met 3 van de hierboven genoemde kenmerken
- - Bij 4 positieve klieren of positieve okseltop na zowel MST als ablatio
- Neo-adjuvante systemische therapie:
- - Stadium III tumoren
- - Overwegen bij stadium II tumoren met indicatie voor systemische therapie en tumorverkleining is gewenst vanwege voorkeur voor MST
Operatieve behandeling
- Lumpectomie (MST):
- Indicaties:
- - Goede locoregionale controle en een fraai cosmetisch resultaat kan worden verkregen
- Contra-indicaties:
- - Multicentriciteit
- - Residuale ziekte
- - Adjuvante radiotherapie geïndiceerd
- Ablatio mammae:
- Indicatie:
- - Multicentriciteit
- - Residuale ziekte
- - Wens patiënt
- - Alternatief voor MST, zeker wanneer MST geen goede locale controle of cosmetisch resultaat levert
- Sentinel Node (SN) Procedure
- Doel:
- - Informatie over okselklierstatus voor prognose en eventueel aanvullende RT of OKD.
- Indicatie:
- - DCIS patienten < 55 jaar
- - DCIS graad 2 of 3
- - DCIS in een groot gebied (groter dan vijf centimeter)
- - Palpabele DCIS
- - Carcinoom
- Contra-indicaties:
- - Bewezen okselkliermetastase
- - T3-4 tumoren
- - Multicentriciteit
- - Eerdere chirurgie axillair
- Okselklierdissectie (OKD)
- Indicatie:
- - Axillaire lymfekliermetastasen
- Overwegen:
- - Bij micrometastasen (SN) kan axillaire radiotherapie worden overwogen
- Complicaties:
- - Aanzienlijke morbiditeit met o.a. pijnklachten, dysesthesie, schouderklachten en lymfoedeem van de arm na OKD
Pathologie
- Prognostische en predictieve factoren:
- - Lymfeklierstatus
- - Grootte
- - Histologische graad
- - Lymfangioinvasie
- - Estrogen Receptor (ER) // Progresteron Receptor (PR)
- - Human Epidermal Growthfactor Receptor 2 (Her2Neu) (0 // 1+ // 2+ // 3+)
- - Genetische profiling (Mammaprint, Oncoprint) 2
- Verdeling hormoonstatus (vanaf 10% expressie dan positief):
- ER+/PR+/Her2- 40%
- ER+/PR-/Her2- 30%
- ER+/PR+/Her2+ 3%
- ER+/PR-/Her2+ 2%
- ER-/PR-/Her2+ 10%
- ER-/PR-/Her2- 15%
- Gradering:
- - Graad 1: goed gedifferentieerd - Nottingham Histologic scores tussen 3-5
- - Graad 2: matig gedifferentieerd - Nottingham Histologic scores tussen 6 en 7
- - Graad 3: weinig/slecht gedifferentieerd - Nottingham Histologic scores tussen 8 en 9
Nottingham Histologic Score system (Elston-Ellis modification of Scarff-Bloom-Richardson grading system) 3-4
| Glandulaire (Acinaire) / Tubulaire Differentiatie | Nucleaire Pleomorfisme | Mitotische telling | |
|---|---|---|---|
| Score 1 | >75% van tumorgebied gevormd door glandulaire/tubulaire structuren | Kleine kern met kleine vergroting in grootte vergeleken met normaal borstepitheelcellen, regular outlines, regelmatige uiteinden, uniforme nucleaire chromatine, kleine variatie in grootte | Minder dan of gelijk aan 7 mitosen per 10 high power velden |
| Score 2 | 10% tot 75% van tumorgebied gevormd door glandulaire/tubulaire structuren | Cellen groter dan normaal met open vesiculaire kernen, zichtbare nucleoli en gematigde variabiliteit in zowel grootte als vorm | 8-14 mitosen per 10 high power velden |
| Score 3 | <10% van tumorgebied gevormd door glandulaire/tubulaire structuren | Vesiculaire kernen, vaak met prominente nucleolen, die een uitgesproken variatie in grootte en vorm hebben, af en toe met zeer grote en bizarre vormen | Gelijk aan of meer dan 15 mitosen per 10 high power velden |
Follow-up
- Mastectomie zonder genmutatie
- - Periode 0-5 jaar: Jaarlijks klinisch onderzoek en mammografie
- - Periode 6-10 jaar (leeftijd <60 jaar): Jaarlijks mammografie, geen klinisch onderzoek
- - Periode 6-10 jaar (leeftijd 60-75 jaar): 2-jaarlijks mammografie bij bevolkingsonderzoek
- MST zonder genmutatie
- - Periode 0-5 jaar: Jaarlijks klinisch onderzoek en mammografie
- - Periode 6-10 jaar (leeftijd <60 jaar): Jaarlijks mammografie, jaarlijks klinisch onderzoek
- - Periode 6-10 jaar (leeftijd 60-75 jaar): 2-jaarlijks mammografie bij bevolkingsonderzoek en jaarlijks klinisch onderzoek bij huisarts
- Patiënten met BRCA 1/2 mutatie (life-time risico borstkanker 60-80% // ovariumcarcinoom 10-20%)
- - Verwijzing polikliniek erfelijke tumoren
- - Periode 0-5 jaar: Jaarlijks klinisch onderzoek, mammografie en MRI
- - Periode 6-10 jaar (leeftijd <60 jaar): Jaarlijks klinisch onderzoek, mammografie en MRI
- - Periode 6-10 jaar (leeftijd 60-75 jaar): 1 of 2-jaarlijks controle, klinisch onderzoek en afhankelijk van beoordeelbaarheid mammografie of MRI
- Patienten >75 jaar
- - Overweeg controles te staken
Referenties
- 1. Nationaal Borstkankeroverleg Nederland (NABON) Landelijk Richtlijn Mammacarcinoom 2.0 Consensus based 2012-02-13, Evidence based 2008-09-01
- 2. Cardoso F, van t Veer LJ, Bogaerts J, Slaets L, Viale G, Delaloge S, Pierga JY, Brain E, Causeret S, DeLorenzi M, Glas AM, Golfinopoulos V, Goulioti T, Knox S, Matos E, Meulemans B, Neijenhuis PA, Nitz U, Passalacqua R, Ravdin P, Rubio IT, Saghatchian M, Smilde TJ, Sotiriou C, Stork L, Straehle C, Thomas G, Thompson AM, van der Hoeven JM, Vuylsteke P, Bernards R, Tryfonidis K, Rutgers E, Piccart M; MINDACT Investigators. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med. 2016 Aug 25;375(8):717-29.
- 3. Bloom, HJ; Richardson, WW (1957). Histological grading and prognosis in breast cancer; A study of 1409 cases of which 359 have been followed for 15 years. British Journal of Cancer. 11 (3): 359–77
- 4. Elston, CW; Ellis, IO (1991). Pathologic prognostic factors in breast cancer. I. The value of histological grades in breast cancer. Experience from a large study with long-term follow-up. Histopathology. 19 (5): 403–10.